· “減肥神藥”司美格魯肽風頭不減。口服片的開發,有助原研藥企諾和諾德趕在專利到期前,進一步擴大在減肥市場的領先優勢。但留給它的時間窗口很小,產能會限制其上市速度,很快它還將直面禮來第三代GLP-1重磅藥物替爾泊肽的“頭對頭”比較挑戰。
· GLP-1藥物全球市場規模有望超越當今“頭牌”PD-1/PD-L1,眾多藥企競相角逐該賽道。但令專家們擔憂的是,司美格魯肽掀起的與疾病無關的“減肥狂熱”,或會帶來更多負面影響。

全球減肥藥市場競爭白熱化。圖片來源:GettyImages
今年以來,被冠以“減肥神藥”之名的司美格魯肽,市場關注度“高燒不退”。跨國藥企諾和諾德(NVO.US)最新公布的OASIS1三期臨床研究結果,為此再添一把火。試驗證明,針對肥胖或超重的成年患者,其正在開發的司美格魯肽口服“減肥藥”,最高50毫克劑量的減肥效果,不輸旗下2.4毫克同成分“明星減肥針”Wegovy。
諾和諾德開發執行副總裁 Martin Holst Lange稱,公司對該結果表示滿意,“有了每日口服片劑和每周注射劑,患者及醫護人員將有機會選擇最適合個人的治療方式。”諾和諾德預計今年內在美國和歐盟遞交該藥的上市申請。而在中國,計劃中的相關三期臨床試驗,已于上月首次在全國15家醫院啟動。
然而,限制諾和諾德的不是產品實力,而是產能。Wegovy自2021年6月在美國上市以來,供不應求,一度波及用于治療糖尿病的“姐妹產品”Ozempic。一周前,諾和諾德甚至宣布推遲其國家廣告計劃,以緩解進一步的藥物短缺。諾和諾德在新聞稿中坦承,50毫克司美格魯肽口服片在全球上市,將取決于產品組合優先順序和制造能力。
如今,Wegovy的“出圈”,徹底帶火了GLP-1藥物開發新賽道。據悉,GLP-1即胰高血糖素樣肽-1,GLP-1可增強胰島素的分泌,減少食物攝入,抑制胃排空和消化道分泌,以及抑制胰高血糖素分泌,對于糖尿病和肥胖患者都有很好的療效。
近年來,國內外藥企均重金加注GLP-1藥物開發,試圖瓜分繼PD-1/PD-L1(一種抗癌免疫療法,通過阻斷PD-1/PD-L1信號通路使癌細胞死亡,利用人體自身的免疫系統抵御癌癥)之后下一個千億美元級“黃金市場”,競爭日趨白熱化。目前占據上風的要數禮來(LLY.US)的替爾泊肽,其減肥針劑正在等候上市批準,未來有可能戰勝Wegovy成為新一代“減肥藥王”。
澎湃科技記者梳理發現,全球研發的GLP-1類減肥新藥多達107款,中國藥企開發的GLP-1類減肥藥物有66款,其中25款已在中國進入臨床階段,2款正在申報上市。而正在開發的司美格魯肽類似藥多達10款,目前僅有一款在不久前獲批肥胖適應征的臨床申請,其余均用于糖尿病治療。
現象級明星減肥藥的誕生
全球肥胖率現已飆升至13%。世界衛生組織(WHO)2016年的最新數據估計,全球有19億人超重,其中6.5億成人患有肥胖癥,另外有近3.8億青少年及兒童超重或肥胖。而在過去三十年里,減肥藥開發數度折戟沉沙,不是因發現嚴重的副作用撤市,就是效果不佳、遭遇商業失敗。
司美格魯肽是諾和諾德繼利拉魯肽之后開發的第二代GLP-1受體激動劑。這類藥物可以模擬一種腸促胰島素激素(胰高血糖素樣肽-1,即GLP-1)的作用,降低血糖水平,同時增加飽腹感,從而有助于控制食欲和體重。

諾和諾德公司引領“肥胖革命”。來源:網絡
針對利拉魯肽和司美格魯肽的開發,諾和諾德均先后拿下了兩種適應征:糖尿病和肥胖。兩款“減肥針”Saxenda(利拉魯肽)與Wegovy(司美格魯肽)的迭代上市,相隔7年時間,不僅打針頻率從每天一次降到每周一次,患者更容易堅持治療,減肥效果也幾乎翻了一倍。
支持Wegovy上市的STEP-1三期臨床研究顯示,每周一次皮下注射2.4mg劑量司美格魯肽,持續68周(約17個月),可以使肥胖或超重患者從平均基線體重105.3公斤下降14.9%,86.4%的患者體重減輕≥5%。同樣結合了生活方式干預的安慰劑組,平均基線體重只下降了2.4%,只有31.5%的患者減重≥5%。在減肥愛好者們眼中,這意味著使用Wegovy就像“開掛”一樣,極大提升常規方法減肥的效果。
同樣是出于提升患者依從性的考慮,諾和諾德乘勝追擊,布局司美格魯肽口服片劑開發。事實上,口服藥物取代注射類多肽是全球制藥業數十年探索的熱點。
5月22日率先公布的OASIS1試驗,總共有667名肥胖或超重的成年患者參與。結果顯示,每日口服一次50mg該藥片,68周(約17個月)后,與平均基線體重相比,患者減重15.1%,如果所有患者堅持治療,減重效果進一步擴大為17.4%,而安慰劑組數據分別為2.4%、1.8%。此外,84.9%的用藥患者減重超過5%,安慰劑組只有25.8%的人達到同樣效果。這一數據接近甚至略優于2.4mg注射劑量的Wegovy。
OASIS是諾和諾德司美格魯肽口服“減肥藥”全球臨床開發計劃,項目包括在美國、歐洲、日本、中國開展的四項試驗。今年4月在中國啟動的三期臨床,計劃招募200名肥胖或超重的成年患者,接受為期44周的治療。入組標準遵循中國對肥胖和超重的BMI指數界定,略低于WHO的標準。值得一提的是,和項目的其他試驗設計一樣,超重的受試者必須同時伴有一種或多種體重相關并發癥,如高血壓、2型糖尿病(T2D)、血脂異常、阻塞性睡眠呼吸暫停或心血管疾病。
Wegovy在中國市場仍處于申報上市階段。目前,僅有更低注射劑量的“降糖針”Ozempic獲批進口上市,商品名為“諾和泰”。同樣用于治療2型糖尿病的司美格魯肽口服片,去年5月申報上市,尚未有更新進展。由于Wegovy海外火爆,近期國內社交媒體平臺上也流傳出不少“攻略”,讓醫生超適應征開出Ozempic處方藥或自行網購該藥,可能影響真正的糖尿病患者用藥,引發爭議。
諾和諾德在中國上市的司美格魯肽注射液“諾和泰”(Ozempic)。圖片來源:視覺中國
“減肥神藥”光環背后的“暗面”尤須關注。藥企正不斷努力提升這類藥物的安全耐受劑量,但常見的副作用仍然可能出現,包括腹瀉、惡心和嘔吐,還可能有罕見的胰腺炎病例。另外,由于這類藥物需要長期服用,以便保持體重穩定,服藥的長期健康影響需要幾十年才能評估。
近來人們開始關心,司美格魯肽等減肥藥減掉的重量里,除了脂肪還有相當比例的肌肉,這可能對長期健康有害,尤其是對老年人而言。還有專家提出,伴隨著節食而來的體重上下波動,可能會增加死亡風險,而個人因服藥體重趨于穩定后,可能不得不服用更高劑量藥物,面臨更大的副作用風險。
還有很多批評集中于減肥藥宣傳中的醫療中心話語,進一步將肥胖“問題化”,可能影響個人尤其是青少年的自尊心和心理健康。如不改善生活方式、環境等因素,僅僅依賴減肥藥,往往治標不治本。
有望躍升“最大規模藥物市場”
根據諾和諾德2022年度財報,由司美格魯肽領銜的GLP-1藥物市場規模,去年首次超過胰島素,成為糖尿病市場的最大驅動力。
如今,在馬斯克等社交媒體紅人親身體驗“帶貨”的推波助瀾下,全球儼然正掀起一場新的“肥胖革命”。上述隱憂顯然也無法阻止GLP-1類減肥藥在臨床和商業開發中的狂飆突進。
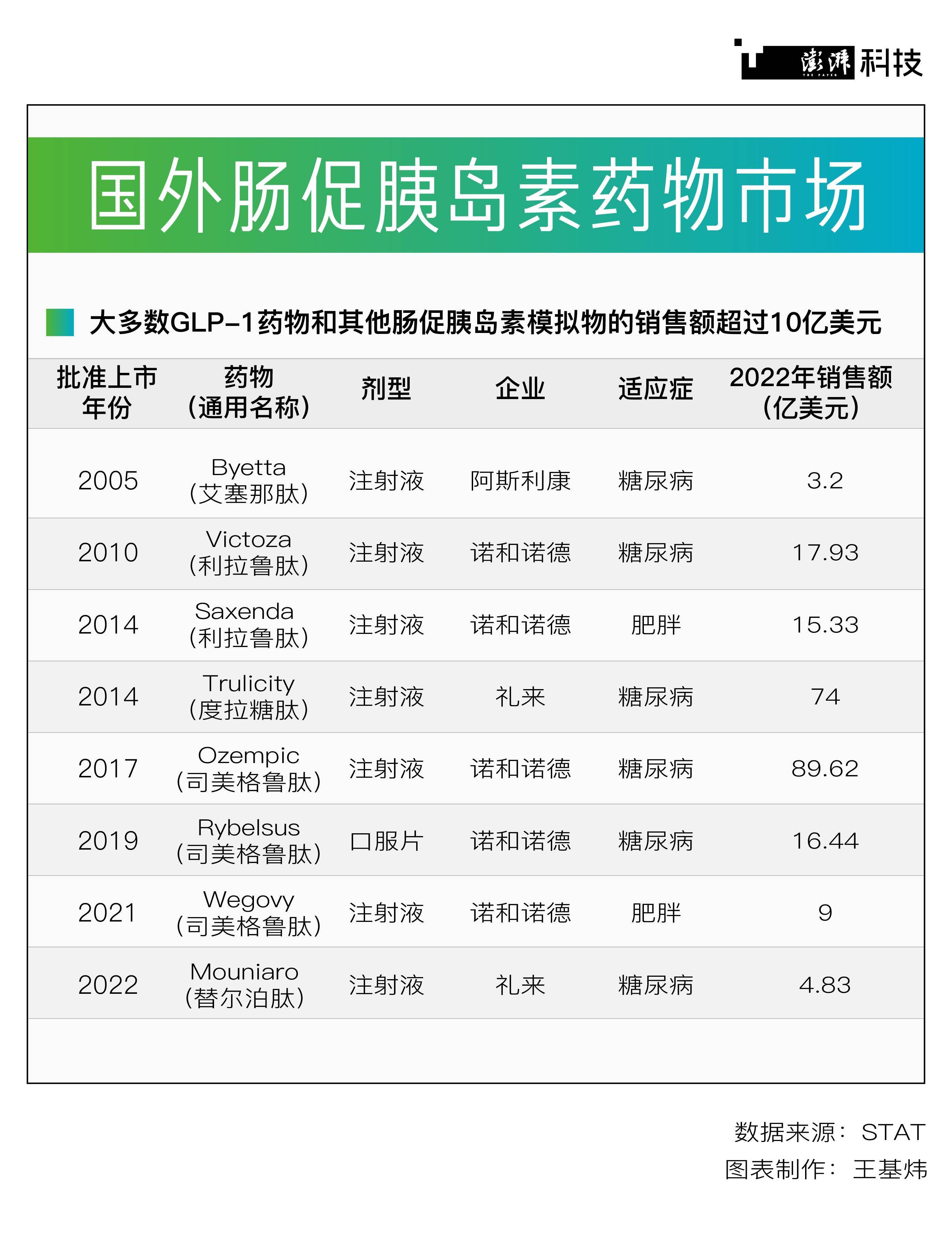
國外上市的腸促胰島素藥物。
自2021年6月在美國上市(次年獲批在青少年人群中使用)以來,Wegovy受到市場熱捧,供不應求。2022年,在產能一度受限的情況下,Wegovy全球銷售額為9億美元,到了今年一季度,銷售額達到6.7億美元,同比大漲225%。今年Wegovy還將陸續登陸英國、法國、韓國等市場。
摩根士丹利據市場需求估算,到2030年,肥胖藥物的市場規模預計超過540億美元,有望超過PD-1/PD-L1成為全球市場規模最大的藥品。同樣正在開發GLP-1藥物的輝瑞則預測,在不到十年的時間內,GLP-1藥物總市場規模可能接近1000億美元。
除了在減肥領域持續突破,顯示出降低心血管疾病風險的益處外,GLP-1藥物還展現出治療多種難治性疾病的潛力,包括非酒精性脂肪性肝炎(NASH)、慢性腎病(CKD)、阿爾茨海默病(AD)。諾和諾德司美格魯肽在內的不少GLP-1藥物,目前正在開展針對這些適應征的臨床試驗。
在全球GLP-1藥物市場上,穩坐第二把交椅的禮來,正在追趕諾和諾德的“霸主”地位。據雙方年度財報披露,2022年,諾和諾德的GLP-1藥物全球銷售額為約118.12 億美元(同比增長 56%),而禮來的GLP-1藥物全球銷售額為約79億美元,分別約占全球GLP-1藥物市場份額的54.9%和29.7%,差距比前一年稍微拉大。兩家公司此前曾共同占據約九成的全球GLP-1藥物市場份額。
禮來開發的Mounjaro(替爾泊肽注射液),2022年5月在美國獲批上市,用于治療2型糖尿病,不到9個月就“吸金”4.83億美元,未來年銷售額有突破100億美元的潛力。這款全新的GPL-1/GIP受體雙靶點激動劑,被視為第三代GLP-1重磅新藥,已在臨床試驗中顯示出比司美格魯肽更強的減重威力。
禮來SURMOUNT-1三期臨床研究顯示,第72周時,不同劑量的替爾泊肽注射液(5mg、10mg、15mg)治療組均展現了出色的減重效果,平均減重最高達22.5%(24kg),最高劑量組有63%患者實現了20%以上的減重。2022年10月,禮來替爾泊肽獲得美國食品藥品監督管理局(FDA)快速通道資格,目前禮來已向FDA滾動提交減重適應征上市申請。

禮來Mounjaro有望戰勝Wegovy,成為新一代“減肥藥王”。圖片來源:網絡
就在今年4月21日,clinicaltrials.gov網站登記了禮來SURMOUNT-5三期臨床試驗,這項“頭對頭”臨床研究將對比替爾泊肽和司美格魯肽治療肥胖的有效性和安全性,相當于禮來和諾和諾德各自的明星減肥產品“正面PK”的戰書。
緊追不舍的還有輝瑞(PFE.US),也瞄準了GPL-1口服藥市場。5月22日,輝瑞開發的小分子藥物Danuglipron也公布了用于治療糖尿病的二期臨床試驗結果,文章發表在醫學期刊《JAMA Network Open 》上。研究顯示,每日兩次服用最高劑量120mg Danuglipron的治療組,在16周內體重減輕了約4.17kg,表明在更短的治療時間內,Danuglipron取得了與諾和諾德的Ozempic在相關臨床試驗中顯示差不多的減重療效。
據輝瑞方面描述,Danuglipron的優勢主要在于不受食物或劑量限制,可開發用于單藥或聯合用藥。據其開發計劃,2022年初,Danuglipron適用于肥胖癥的三期臨床啟動,2025年申報上市,2026年獲批上市。
這里還有一個插曲。成立于2018年的中國創新藥企銳格醫藥,兩位核心團隊成員曾在輝瑞擔任要職。其推出的首個產品RGT-075也是一款口服小分子GLP-1受體激動劑,目前已在美國進入二期臨床,可用于治療2型糖尿病、肥胖、非酒精性脂肪肝等適應征。
然而,2022年2月初,輝瑞突然起訴銳格醫藥及兩位前雇員,指責其開發的GLP-1藥物專利與輝瑞的“驚人相似”,懷疑其竊取了輝瑞的商業機密,要求其將專利申請權回轉給輝瑞,賠償損失。就在2個月前,銳格醫藥與禮來就一款處于研發早期階段的小分子GLP-1R受體激動劑,達成高達15億美元的license-out(專利授權)戰略合作,禮來將負責除大中華區外的臨床開發、生產及商業化。
這場訴訟凸顯了藥企爭搶減肥市場的迫切性。銳格醫藥方面接受媒體采訪時表示,輝瑞訴訟毫無依據,會全力進行辯護,維護合法權益。該訴訟仍在進行中,可能會持續幾年時間。
目前,其他跨國藥企也在紛紛涌入該賽道。安進(AMGN.US)、阿斯利康(AZN.US)、賽諾菲(SNY.US)、勃林格殷格翰(Boehringer-Ingelheim)等都在布局GLP-1減肥藥物開發。其中勃林格殷格翰的BI 456906 已在中國完成二期臨床試驗。
中國GLP-1賽道“內卷”加劇
諾和諾德與輝瑞的GLP-1新藥最新臨床數據公布后,中國研發GLP-1藥物的上市藥企,一時間股票幾乎全線飄紅。最具戲劇性的要數布局司美格魯肽原料藥的諾泰生物(688076)。5月22日晚,諾泰生物發布公告稱,公司與一家歐洲專注于創新藥物的大型藥企簽訂了主服務及供貨合同,合同標的為cGMP高級醫藥中間體(Current Good Manufacture Practices的縮寫,也譯作現行藥品生產管理規范,cGMP是國際藥品生產管理標準),合同累計金額約1.02億美元。
市場傳聞指該合同或與諾和諾德及司美格魯肽有關。5月23日早盤,諾泰生物大幅高開,當日收盤時,上漲12.98%。隨后,諾泰生物回應媒體稱,因涉及商業機密不便告知。而在投資者互動平臺上,諾泰生物回復投資者詢問稱,公司目前與諾和諾德沒有任何相關合作。
除諾泰生物外,天吉生物、麗珠集團新北江制藥等多家公司提交了司美格魯肽原料藥上市申請。而諾泰生物還躋身于GLP-1減肥新藥研發行列。去年7月,諾泰生物SPN0103-009注射液的臨床試驗申請獲批,擬用于治療2型糖尿病和肥胖癥,并最終拓展到非酒精性脂肪肝和阿爾茨海默病。

中國藥企GLP-1賽道競爭“內卷化”。
今年有兩款GLP-1國產減肥藥有望上市,分別是仁會生物原研的BEM-014注射液(貝那魯肽),和華東醫藥子公司中美華東的仿制藥利拉魯肽注射液。
2021年10月,仁會生物的這款貝那魯肽注射液,作為首款GLP-1國產糖尿病新藥上市,商品名為誼生泰。去年3月,仁會生物提交該藥肥胖適應征上市申請,商品名擬為菲塑美。
今年3月,中美華東的利拉魯肽注射液獲批上市,與諾和諾德的一代GLP-1糖尿病藥Victoza成分類似,商品名為利魯平。去年7月,該藥也已針對肥胖癥適應征申報上市。
作為老牌胰島素細分龍頭企業,通化東寶研發的用于治療糖尿病的利拉魯肽,預計也將于今年年底獲批上市,不過目前尚沒有資料顯示通化東寶有開發該藥肥胖適應征的計劃。仿制利拉魯肽注射液減肥藥的企業還有復星醫藥子公司萬邦生化和愛美客子公司諾博特生物,項目分別處于三期和一期臨床階段。這些產品未來都需要面臨司美格魯肽的“追擊”。
面向減肥市場,通化東寶選擇押寶在GLP-1/GIP雙靶點激動劑THDBH120/121,對標禮來替爾泊肽,寄予了成為“更長效的治療糖尿病和肥胖的重磅藥物”的期待,目前糖尿病適應征已獲批臨床,不久后也將開發肥胖適應征。此外公司還有一款GLP-1新藥THDBH110/111,目前還在臨床前研究階段。
國內糖尿病領域龍頭企業華東醫藥,則正在加快全球市場布局GLP-1新藥。其控股子公司道爾生物開發的全球首創GLP-1R/GCGR/FGF21R長效三靶點激動劑DR10624正在新西蘭開展一期臨床試驗,獲批適應征包括2型糖尿病、肥胖、代謝綜合征等;華東醫藥還從日本SCOHIAPHARMA,Inc.引入GLP-1R/GIPR雙靶點激動劑SCO-094及其衍生產品,SCO-094在英國已進入臨床二期,而華東醫藥將在中國啟動SCO-094產品2型糖尿病、減肥等適應征的臨床試驗。
不少中國創新藥企已經攜減肥產品出海。針對肥胖適應征,在中國已進入三期臨床階段的先為達XW003(依諾魯肽)注射液,同時正在澳洲開展二期臨床,先為達的依諾魯肽口服制劑XW004、口服片XW014均在美國開展I期臨床;鴻運華寧的GMA106在澳洲開展I期臨床,近期在中國獲批臨床;碩迪生物口服GSBR-1290正在日本和美國分別進行二期和一期臨床;德睿智藥的MDR-001片的臨床申請已在中美雙雙獲批。
質肽生物在研的10個產品管線中,ZT002注射液、ZT003注射液、ZT006口服片均選擇“中、美、澳三報”,其中ZT002推進最快,已在澳大利亞完成一期臨床,在中國也已獲批2型糖尿病和肥胖兩個適應征。而其司美格魯肽注射液仿制藥ZT001也在中國進入一期臨床。值得一提的是,成立于2018年的質肽生物專攻糖尿病、肥胖等代謝領域疾病,多位核心團隊均出自諾和諾德。
華東醫藥的兩家子公司九源基因和中美華東,還各自握有一款司美格魯肽類似藥,2型糖尿病適應征的國內臨床進度分別處于三期和一期。等不及諾和諾德的司美格魯肽2026年專利到期,華東醫藥對其提出專利挑戰,2022年9月5日,國家知識產權局判定司美格魯肽核心專利全部無效,但諾和諾德提出了上訴,案件還未塵埃落定。
澎湃科技記者統計發現,目前國內企業研發的司美格魯肽類似藥至少有10款,唯一一家已就肥胖適應征申請臨床并獲批準的,是聯邦制藥(03933.HK)的司美格魯肽類似藥,其針對2型糖尿病的臨床試驗也已進入三期。它們都躍躍欲試想在2026年前搶先“分一杯羹”。
而在國產減肥藥開發第二梯隊中,信達生物(01801.HK)的雙靶點受體激動劑IBI362(瑪仕度肽)注射液有望率先撞線。該藥自禮來引進,信達生物擁有中國地區的商業化權益。5月11日,信達生物公布了積極的二期臨床數據,治療24周后,9毫克治療組的體重相對基線平均下降15.4%,堪比頭部企業。目前三期臨床正在進行,一切順利的話,該藥有望在2024年年底或2025年初上市。
在其身后,恒瑞醫藥、石藥集團、甘李藥業、東陽光長江藥業、博瑞生物、眾生藥業、信立泰、樂普醫療、翰森制藥、諾泰生物等上市藥企紛紛入局,先為達、鴻運華寧、聞泰醫藥、派格生物、德睿智藥、民為生物、碩迪生物等創新藥企各顯神通,靶點、成分類型和劑型較為多樣。
賽道如此擁擠,未來對于這些企業而言,除了用產品效力和安全性數據說話,在商業化上也將面臨很大的考驗。

進入臨床的中國藥企GLP-1減肥藥物一覽。